NapaJen Pharmaの核酸医薬送達技術
NapaJenの送達技術の特徴は、マクロファージ、樹状細胞など抗原提示細胞の表面に発現し、β-グルカンを特異的に認識するDectin-1受容体に核酸医薬を選択的に送達することにあります。 NapaJen Pharmaは、核酸とSPGと言われるβ-グルカン鎖との複合体を作製する技術を開発し、免疫応答の調節において重要な役割を果たす免疫細胞などDectin-1陽性細胞に核酸医薬を効率的かつ選択的に送達することを可能にしました。
核酸医薬- SPG複合体の作製
NapaJenの開発した核酸医薬-SPG複合体の作製方法は以下のステップから成っています。
- 三重らせんSPGの1本鎖への変性(Denature)
- 選択した核酸医薬へのポリデオキシアデニン(poly(dA)の付加
- 一本鎖SPG混合物へのpoly(dA)が付加された核酸医薬の添加
- Poly(dA)部分がSPG鎖の三重らせん構造への取り込み(Renature)
- 核酸医薬-SPG複合体の完成
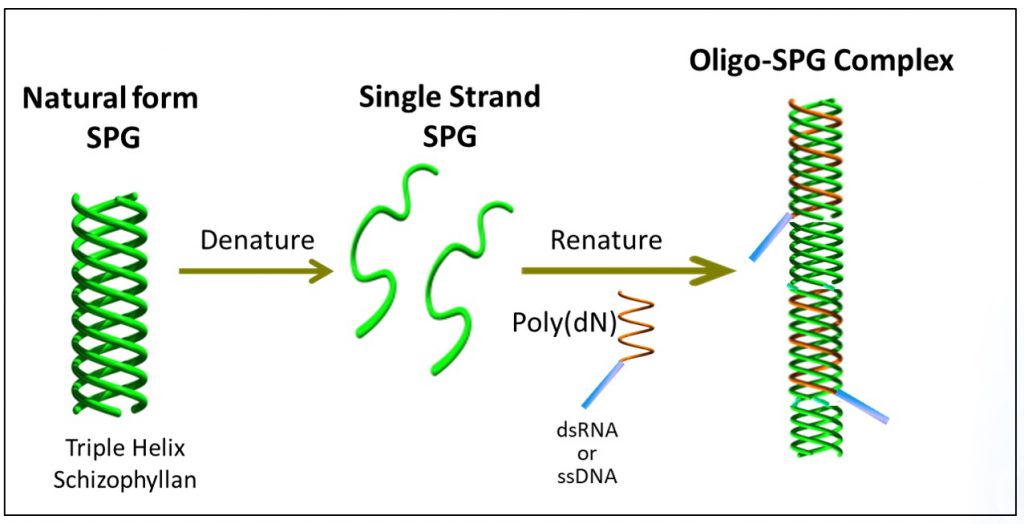
オリゴ複合体の開発
核酸医薬- SPG複合体の物性について
NapaJen Pharmaの持つユニークな核酸医薬-SPGの物性について簡単に示します。
2001年イギリスの研究者たちによって、血中の単核球、マクロファージや樹状細胞などの細胞表面に多糖類の一種であるβ-1,3グルカンを特異的に認識する受容体Dectin-1 が発見されました(文献1)。
同時期、NapaJen Pharma(以下NapaJen社)では、北九州大学櫻井教授と共同で、核酸とβ-1,3グルカンの一種であるSPG(Schizophyllan Glucan)との複合体作成に成功しました。この複合体により、核酸医薬をDectin-1陽性免疫細胞に効率的に送達することが世界で初めて可能となりました。
SPGは三重らせん構造(triple helix)を形成しており、塩基性条件下では一本鎖へ解離し、中性条件下に戻すことにより三重らせん構造が再生します。この中性条件へ戻す際、ポリデオキシアデニン(poly-dA)を有する核酸が存在すると二本のSPGとpoly-dA部分とが三重らせん構造を再生して複合体を形成します。SPGと核酸が複合体を形成していることは、ゲル電気泳動(PAGE)で簡単に確認することができます。SPGが最も安定な複合体を形成するのはデオキシアデニンが連続したpoly-dAであり、他のオリゴマーであるポリデオキシグアニン(dG)やポリデオキシシトシン(dC)とは複合体を形成しないことがわかっています(文献2)。核酸はSPGと複合体を形成すると高分子量化するためにゲルの中に流れ出していきません(図1の右端)。このようになぜglucan鎖がpoly-dAのみを認識して複合体を形成するのかという分子認識機構はまだ完全には解明されていません。
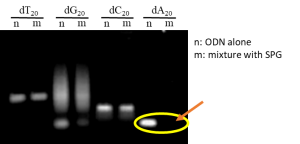
図1. ゲル電気泳動
NapaJen社では多糖核酸複合体の分析法は、Gel Permeation Chromatography(GPC、別称Size Exclusion Chromatography: SEC)法を用いており、多角度光散乱検出器(Multi Angle Light Scattering: MALS)を利用することによって分子の大きさについても測定することが可能となります。このMALSは医薬品の物性評価に必要な定量性、再現性を重視した測定法です(文献3)。すなわち、MALSを用いると高分子がゲルの中を進むとき分子の大きさにより分画される現象を利用して、流出液からの静的光散乱を測定することによって絶対分子量、平均分子量や分子量分布を各分画において求めることができます。図2にその一例を示します。また、同時に溶液のUV吸収と屈折率を測定することで各分画中に含まれるDNAやSPG組成なども測定が可能です。
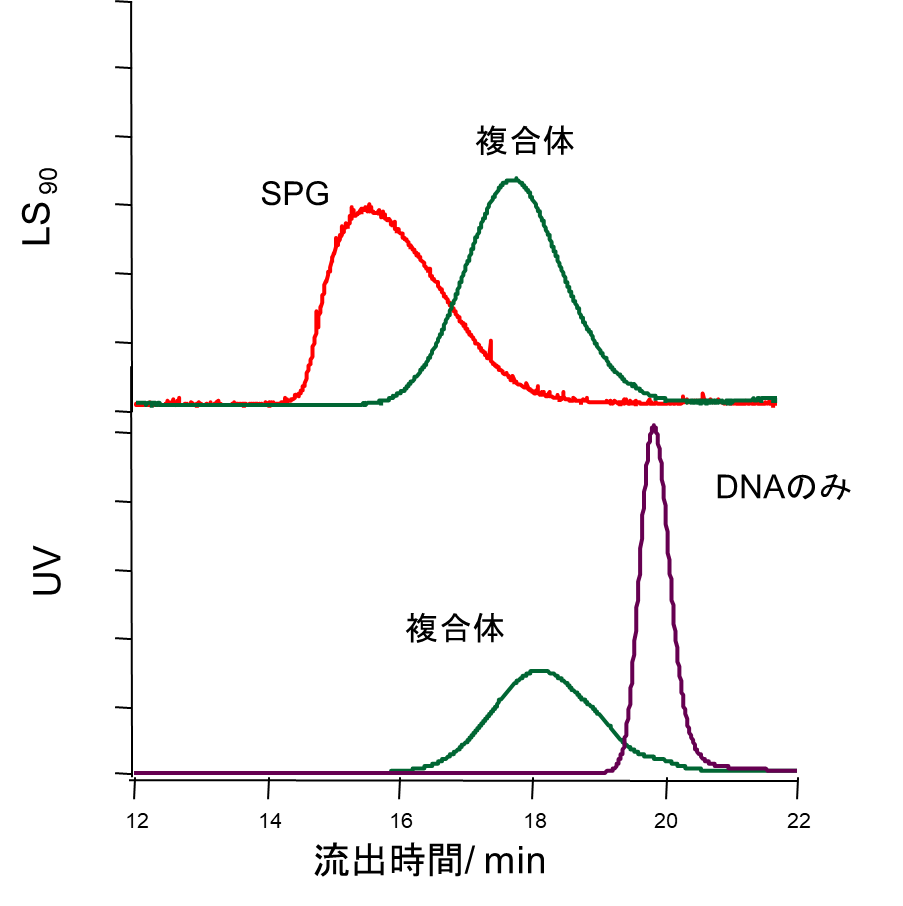
図2. GPC-MALSを用いた測定
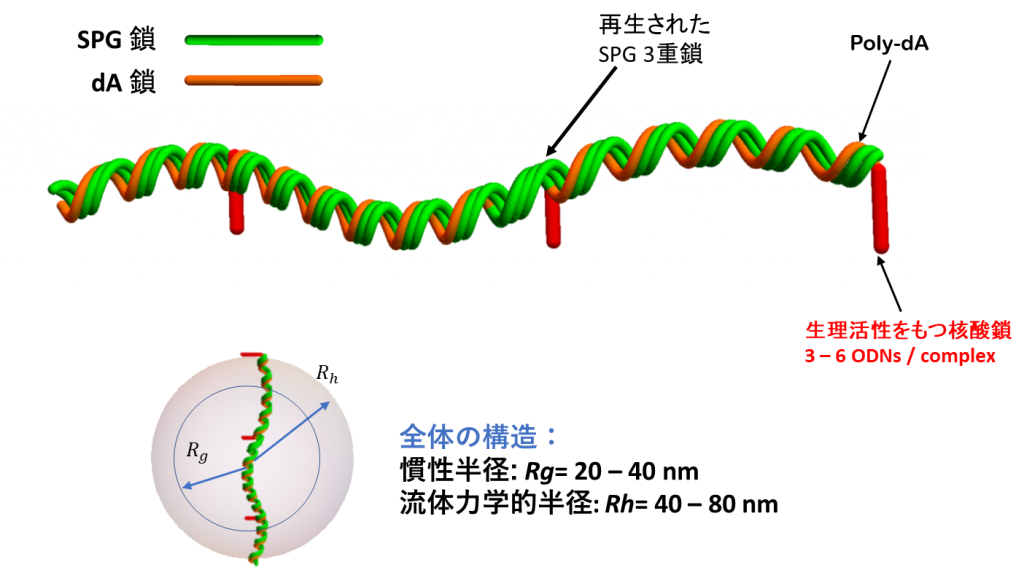
NapaJen社で設定した分析法から、核酸-SPG複合体に関して以下のことが判明しました。複合体は半屈曲性(曲がることができる、柔軟性をもつ)の直鎖状の形態を取っています。得られた複合体は分子量分布を持ちますが、平均の分子量は約400,000です。生理活性をもつヘテロな核酸配列はこの直鎖から枝分かれして突き出しています。一つの複合体中には、3~6分子の核酸を含んでいます。その大きさは流体力学的半径(Rh)で40~80 nmです。このような分子の形態はAFM(Atomic force microscope: 原子間力顕微鏡)から確認することができます。
引用文献
- Brown, G. D. and Gordon, S. A new receptor for β-gluans. Nature 413, 36–37 (2001).
- (a) Sakurai, K. et al. Polysaccharide−Polynucleotide Complexes. 2. Complementary Polynucleotide Mimic Behavior of the Natural Polysaccharide Schizophyllan in the Macromolecular Complex with Single-Stranded RNA and DNA. Biomacromolecules, 2, 641-650 (2001). (b) Mochizuki S. and Sakurai, K. Dectin-1 targeting delivery of TNF-α antisense ODNs complexed with β-1,3-glucan protects mice from LPS-induced hepatitis. J. Control. Release, 151, 155-161 (2011).
- Sanada, Y. et al. β-1,3-d-Glucan Schizophyllan/Poly(dA) Triple-Helical Complex in Dilute Solution. The Journal of Physical Chemistry B, 116, 87-94 (2012).
核酸医薬-SPG複合体を利用した標的特異的な送達と細胞への取り込みの機序
SPGの受容体として機能するDectin- 1は、全身のうち主にマクロファージ/単球や樹状細胞などの免疫細胞に発現しています。NapaJen 独自の方法で作製された核酸医薬-SPG複合体は、これらのDectin-1陽性免疫細胞に選択的に送達されます。 核酸医薬- SPG複合体が標的細胞に送達されると、複合体は細胞内エンドソームに取り込まれ、その後細胞質に入ります。 核酸医薬ーSPG複合体が細胞内に入ると、核酸医薬はその種類に依存し以下のように作用すると考えられています。 TLR9アゴニスト核酸医薬:エンドソームのTLR9に結合して、インターフェロンαなどのサイトカインを誘導します。 二本鎖RNA(dsRNA)核酸医薬:エンドソームを抜けた後、ガイド鎖はRISCに組み込まれ、標的mRNAに結合して切断を誘導します。 一本鎖DNA(ssDNA)核酸医薬:標的mRNAに直接結合し、RNase Hによる標的mRNAの切断を誘導します。
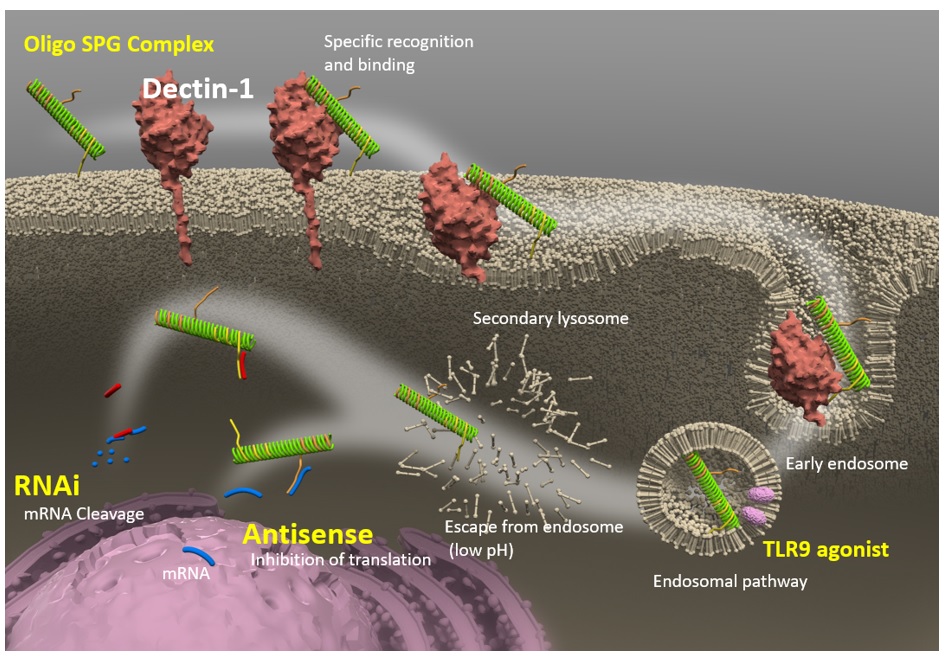 Dectin-1 発現細胞における核酸医薬-SPG 複合体の取り込みとその後の流れを示す。
Dectin-1 発現細胞における核酸医薬-SPG 複合体の取り込みとその後の流れを示す。
NapaJenのこれまでの核酸医薬送達技術を評価した結果、当社の核酸医薬-SPG複合体の主な利点は次の通りであると考えています。
- 標的細胞への核酸医薬の効率的・安定的な送達
- サルを用いた試験結果とヒトでのFIH (First in Human)臨床試験から明らかにされた高い安全性プロファイル
- 多様な核酸モダリティへの応用が可能
